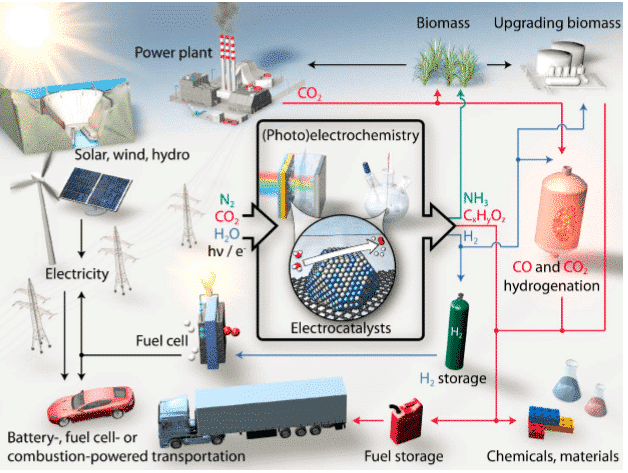
La tecnología de reacción electrocatalítica es uno de los métodos clave que impulsan estas vías de conversión de energía y purificación ambiental.
En los últimos años, con el desarrollo de la sociedad y el progreso de la humanidad, los problemas ambientales y energéticos cada vez más graves se han convertido en un problema mundial que debe resolverse con urgencia. Las personas están comprometidas con el uso efectivo de nuevas fuentes de energía y métodos de purificación del medio ambiente a largo plazo. Los métodos de investigación efectivos actuales para promover la conversión de energía y la purificación ambiental involucran muchas direcciones, como el desarrollo de celdas de combustible, producción de hidrógeno, recursos de CO2, conversión catalítica orgánica de gases de escape. Los métodos de prueba electroquímicos como guía teórica proporcionan un medio racional de interpretación para el desarrollo del rendimiento del electrocatalizador. Este artículo resume los métodos de prueba electroquímicos comúnmente utilizados en varias reacciones electroquímicas.
Figura 1 Proceso electrocatalítico de conversión de energía sostenible
1.voltametría cíclica
La voltametría cíclica (CV) es el método de investigación más utilizado para evaluar sistemas electroquímicos desconocidos. Se obtiene principalmente controlando el potencial del electrodo a diferentes velocidades y escaneando una o más veces con una forma de onda triangular a lo largo del tiempo. Curva de potencial actual (iE). Diferentes reacciones de reducción y oxidación pueden ocurrir alternativamente en los electrodos en diferentes rangos potenciales. La reversibilidad de la reacción del electrodo se puede juzgar de acuerdo con la forma de la curva; Los picos de adsorción y desorción de los reactivos pueden usarse para evaluar el electrocatalizador de acuerdo con el rango de potencial específico. El área catalíticamente activa también se puede utilizar para obtener información útil sobre reacciones complejas de electrodos.
Figura 1.1 Análisis de la curva de respuesta potencial actual
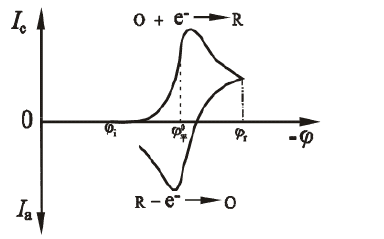
Como se muestra en la figura 1.1, el potencial de la primera mitad se escanea hacia el cátodo, y la sustancia electroactiva se reduce en el electrodo para generar una onda de reducción. Cuando se explora el potencial de la segunda mitad hacia el ánodo, el producto de reducción se oxida nuevamente sobre el electrodo para generar una onda de oxidación. Dos parámetros útiles de la curva iE de voltametría cíclica son la relación de corriente máxima ipa / ipc y la diferencia de potencial máxima Epa-Epc. Para la onda Nernst del producto estable, la relación de corriente máxima ipa / ipc = 1, independiente de la velocidad de exploración, el coeficiente de difusión y el potencial de conmutación. Cuando se detiene la exploración del cátodo, la corriente se degrada a 0 y luego se invierte la exploración. La curva iE obtenida es exactamente la misma que la curva del cátodo, pero se dibuja en la dirección opuesta de la coordenada I y la coordenada E. La relación ipa / ipc se desvía de 1, lo que indica que el proceso del electrodo no es un proceso de reacción totalmente reversible que implique una cinética homogénea u otras complicaciones. La altura del pico de reacción y el área del pico pueden usarse para estimar parámetros del sistema tales como la concentración de especies electroactivas o la constante de velocidad de la reacción homogénea acoplada. Sin embargo, la curva CV no es un método cuantitativo ideal, y su uso poderoso se basa más en su capacidad de evaluación cualitativa semicuantitativa.
2.voltametría de pulso
La voltamperometría de pulso es un método de medición electroquímica basado en el comportamiento de los electrodos polarográficos. Se utiliza para estudiar el proceso redox en diversos medios, la adsorción de materiales de superficie en materiales catalíticos y el mecanismo de transferencia de electrones en la superficie de electrodos modificados químicamente. La detección es especialmente efectiva. La voltamperometría de pulso incluye voltamperometría escalonada, voltamperometría de pulso convencional, voltamperometría de pulso diferencial y voltamperometría de onda cuadrada dependiendo de la forma en que se escanea el voltaje. Entre ellos, la voltamperometría de pasos es similar al método de barrido potencial, y la respuesta de la mayoría de los sistemas a voltamperios de paso de resolución más alta (ΔE <5 mV) es muy similar a los resultados del experimento de exploración lineal de la misma velocidad de exploración.
3. espectroscopía de impedancia electroquímica
La espectroscopía de impedancia electroquímica es aplicar una señal eléctrica perturbada al sistema electroquímico. A diferencia del método de exploración lineal, el sistema electroquímico está muy lejos del estado de equilibrio, y luego se observa la respuesta del sistema, y las propiedades electroquímicas del sistema se analizan mediante la señal eléctrica de respuesta. La espectroscopía de impedancia electroquímica a menudo se usa para analizar, evaluar la reacción de ORR en celdas de combustible PEM, caracterizar la pérdida de difusión en la superficie del material catalítico, estimar la resistencia óhmica y las características de la impedancia de transferencia de carga y la capacidad de doble capa para evaluar y optimizar El conjunto de electrodos de membrana.
El espectro de impedancia generalmente se dibuja en forma de un diagrama de Bode y un diagrama de Nyquist. En el diagrama de Bode, la magnitud y la fase de la impedancia se representan en función de la frecuencia; En el diagrama de Nyquist, la parte imaginaria de la impedancia se representa en cada punto de frecuencia en relación con la parte real. El arco de alta frecuencia refleja la combinación de la capacitancia de doble capa de la capa de catalizador, la impedancia efectiva de transferencia de carga y la resistencia óhmica, que refleja la impedancia producida por la transferencia de masa. Para un sistema dado, las dos regiones a veces no están bien definidas.
Figura 3.1 Espectro de impedancia del sistema electroquímico
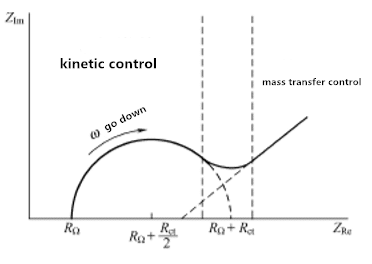
La figura 3.1 muestra las características extremas del control cinético y el control de transferencia de masa. Sin embargo, para cualquier sistema dado, las dos regiones probablemente no están bien definidas. El factor determinante es la relación entre la resistencia de transferencia de carga y la impedancia de transmisión. Si el sistema químico es lento en cinética, mostrará un Rct grande, que parece tener una región de frecuencia muy limitada. Cuando el sistema es dinámico, la transferencia de material siempre juega un papel principal, y las áreas semicirculares son difíciles de definir.
4. cronoamperometría
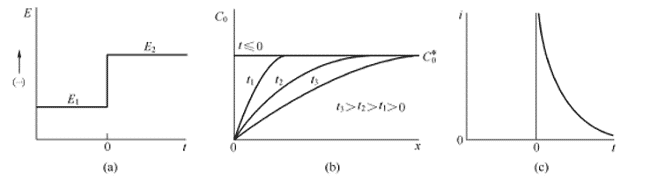
El método de cronoamperometría es un método de control transitorio que se puede utilizar para evaluar la adsorción y difusión de la superficie del catalizador. La curva de cronoamperometría se obtiene aplicando un paso potencial al sistema electroquímico para medir el cambio de la señal de respuesta actual a lo largo del tiempo. Cuando se da un paso potencial, la forma de onda básica se muestra en la Figura 4.1 (a), y la superficie del electrodo sólido se analiza con un material electroactivo. Después de que se aplica el paso potencial, las especies electroactivas cerca de la superficie del electrodo se reducen primero a un radical aniónico estable, que requiere una gran corriente ya que el proceso ocurre inmediatamente en el instante del paso. La corriente que fluye posteriormente se usa para mantener las condiciones bajo las cuales el material activo de la superficie del electrodo se reduce por completo. La reducción inicial provoca un gradiente de concentración (es decir, concentración) entre la superficie del electrodo y la solución a granel, y el material activo comienza a difundirse continuamente hacia la superficie y al electrodo. El material activo en la superficie se reduce completamente de inmediato. El flujo de difusión, es decir, la corriente, es proporcional al gradiente de concentración de la superficie del electrodo. Sin embargo, se observa que a medida que avanza la reacción, el material activo en la solución a granel se difunde continuamente hacia la superficie del electrodo, haciendo que la región del gradiente de concentración se extienda gradualmente hacia la solución a granel, y el gradiente de concentración superficial del electrodo sólido gradualmente se vuelve más pequeño (agotado) y la corriente cambia gradualmente. pequeña. La distribución de la concentración y la corriente frente al tiempo se muestran en la Figura 4.1 (b) y la Figura 4.1 (c).
Figura 4.1 (a) Forma de onda experimental escalonada, el reactivo O no reacciona al potencial E1, se reduce a E2 a la velocidad límite de difusión; (b) distribución de concentración en diferentes momentos; (c) curva de corriente versus tiempo
5. tecnología de electrodos de disco giratorio
La tecnología de electrodo de disco giratorio (RDE) es muy útil para estudiar la reacción homogénea acoplada de la superficie del catalizador, de modo que la reacción electroquímica en la superficie del catalizador se lleva a cabo bajo una condición de estado relativamente estable. RDE puede controlar sustancias con difusión más lenta, como el gas que se difunde fácilmente en la solución, reduciendo la influencia de la capa de difusión en la distribución de densidad de corriente. Por lo tanto, se obtiene una densidad de corriente estable, que está en un estado estable aproximado, lo que es beneficioso para el proceso de análisis electroquímico; RDE puede controlar la velocidad a la que el electrolito alcanza la superficie del electrodo ajustando la velocidad de rotación y medir los parámetros del proceso de reacción electrocatalítica a diferentes velocidades de rotación. análisis.
A medida que los humanos se interesan más en el desarrollo de electrocatalizadores avanzados para la conversión de energía limpia, además de enfatizar el uso de algunos métodos básicos para la caracterización de reacciones electrocatalíticas, se necesita un examen más detallado de los pasos elementales de cada reacción para determinar la combinación involucrada. intermedios, la superficie del intermedio y la energía de cada paso de reacción elemental. El estudio de los métodos electroquímicos aún requiere muchos detalles sobre la interfaz electrodo-electrolito que no se conoce hasta ahora, como la cinética y las barreras de reacción involucradas en los pasos elementales clave de la transferencia de protones / electrones; cerca de solventes, cationes e interfaces de reacción. La descripción del estado atómico a nivel molecular del anión; y los métodos de adquisición de señal en tiempo real más rápidos y eficientes en todo el proceso de reacción electroquímica todavía están a la vanguardia de las reacciones electrocatalíticas. En resumen, el estudio en profundidad de los métodos de caracterización electroquímica proporciona una estrategia orientadora para el desarrollo de nuevos sistemas catalíticos de alta eficiencia.