제선방법에는 주로 고로법, 직접환원법, 제련환원법 등이 있으며 원리는 특정 분위기(환원물질인 Co, H2, C, 적정 온도 등)에서 광석을 물리화학적 반응시켜 환원선철을 얻는 원리이다. .). 주조에 사용되는 선철의 일부 외에 대부분이 제강 원료로 사용됩니다.
고로 제철은 현대 제철의 주요 방법이자 철강 생산의 중요한 연결고리입니다. 우수한 기술 및 경제 지표, 간단한 공정, 대규모 생산 능력, 높은 노동 생산성 및 낮은 에너지 소비로 인해 고로 공정에서 생산되는 철은 세계 총 철 생산량의 95% 이상을 차지합니다.
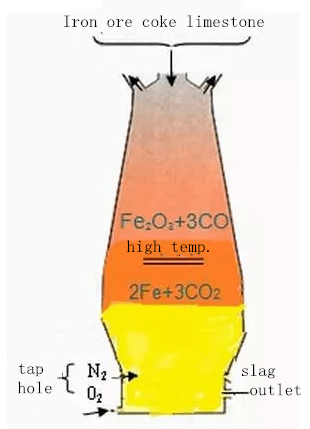
고로 제철의 개략도
고로는 원통형 용광로와 유사하며 외부는 철판으로 덮여 있고 내부 벽은 내화 벽돌로 덮여 있습니다. 전체 용광로는 깊은 콘크리트 기초 위에 지어졌습니다.
고로 생산 시 철광석, 코크스, 슬래그 제조 플럭스(석회석)를 용광로 상부에서 장입하고, 예열된 공기를 용광로 둘레를 따라 용광로 하부에 위치한 송풍구로 불어넣습니다. 고온에서는 코크스 속의 탄소와 공기 중에 불어넣은 산소가 연소되면서 발생하는 일산화탄소와 수소가 용광로에서 승온하는 과정에서 철광석 속의 산소를 제거하여 철을 얻는다. 쇳물이 수도꼭지에서 배출됩니다.
철광석의 비환원성 불순물은 석회석 및 기타 플럭스와 결합하여 슬래그를 형성하고 슬래그 포트에서 배출됩니다. 생산된 가스는 용광로 상단에서 배출되며 먼지 제거 후 열간 용광로, 가열로, 코크스로 및 보일러의 연료로 사용됩니다.
원료 : 철광석, 용제, 연료
철광석
천연 채굴 광석의 화학적 조성, 물리적 상태 및 기타 측면에서 고로 제련 요구 사항을 충족하는 것은 어렵습니다. 고로에 고급스럽고 균일한 조성과 입자크기를 공급하기 위해서는 파쇄, 스크리닝, 선광, 연탄, 혼합 등의 공정을 거쳐 제조, 처리되어야 합니다.
야금 산업에서 일반적으로 사용되는 철광석에는 네 가지 종류가 있습니다.
| 미네랄 유형 | 주요 구성품 | 철분의 이론적인 함량 | 自然含铁(자유량) |
| 적철광 | Fe2O3 | 70% | 50%~60% |
| 자철광 | Fe3O4 | 72.4% | 40%~70% |
| 갈철석 | 2Fe2O3·3H2O | 59.8% | 37%~55% |
| Siderite | FeCo3 | 48.2% | 低 |
용제
광석의 맥석과 연료의 회분에는 녹는점이 높은 일부 화합물이 포함되어 있습니다(예: SiO2의 녹는점은 1625℃이고 Al2O3의 녹는점은 2050℃입니다). 고로의 용융 온도에서는 녹지 않아 액체로 될 수 없으므로 용철과 잘 분리되지 않습니다. 동시에, 용광로의 작동도 어렵다.
플럭스를 첨가하는 목적은 이러한 고융점 화합물과 함께 저융점 슬래그를 형성하여 용광로의 제련 온도에서 완전히 액화하고 상당한 유동성을 유지하여 금속과의 우수한 분리 목적을 달성하고 선철의 품질.
플럭스는 성질에 따라 염기성 플럭스와 산성 플럭스로 나눌 수 있다. 어떤 플럭스를 사용할지는 광석의 맥석과 연료의 재의 특성에 따라 달라집니다. 천연 광석의 대부분 맥석은 산성이고 코크스의 회분 함량은 산성이므로 석회석과 같은 알칼리성 플럭스가 일반적으로 사용됩니다. 산성 플럭스는 거의 사용되지 않습니다.
연료
고로 제련에 필요한 열은 주로 연료의 연소에 따라 달라집니다. 동시에 연료는 연소 과정에서 환원제 역할도 하기 때문에 연료는 고로 제련의 주요 원료 중 하나입니다. 일반적으로 사용되는 연료는 주로 코크스, 무연탄 및 세미 코크스입니다.
물리화학적 공정 : 고온 환원반응 + 슬래깅반응
고로 제련의 목적은 철광석에서 철을 환원시켜 불순물을 제거하는 것입니다. 전체 제련 과정에서 가장 중요한 것은 철분의 환원과 슬래깅 반응입니다.
또한 물과 휘발성 물질의 증발, 탄산염의 분해, 철의 탄화 및 용해, 기타 원소의 환원 등 일련의 복잡한 물리적, 화학적 반응이 수반되는데, 이는 오직에서만 실현될 수 있습니다. 특정 온도. 따라서 제련과정에서도 연료연소가 필요조건으로 필요하다.
연료의 연소
C+O2→CO2
부담의 분해
물의 증발과 결정수의 분해; 휘발성 물질 제거; 탄산염의 분해.
고로에서의 환원반응
철분의 감소
고로에서 철은 고가의 산화물에서 직접적으로 환원되지 않고, 고가의 산화물에서 저가의 산화물로, 다시 저가의 산화물에서 철로 환원되는 과정을 거쳐 Fe2O3 → Fe3O4 → FeO → Fe
철의 환원은 주로 환원제인 일산화탄소 가스와 고체 탄소에 의존합니다. 일산화탄소의 환원을 보통 간접환원이라 하고, 고체탄소의 환원을 직접환원이라 한다.
간접환원의 총반응은 3fe2o3 + 9co → 6fe + 9co2
직접 환원의 전체 반응은 3fe2o3 + C → 2fe3o4 + Co
철의 탄화
광석에서 환원된 철은 고체 해면질이며 탄소 함량은 일반적으로 1% 미만으로 매우 낮습니다. Co는 낮은 온도에서 분해되고 분해된 C는 활성이 강하므로 철과 접촉하면 철탄소합금을 형성하기 쉽습니다.
따라서 고체 해면철은 더 낮은 온도(400℃~600℃)에서 침탄되기 시작합니다. 화학 반응은 다음과 같습니다: 2CO + 3Fe → Fe3C + CO2 또는 3Fe(액체) + C(고체) → Fe3C
슬래깅 공정
슬래깅은 광석에 함유된 맥석과 연료에 함유된 회분을 플럭스와 결합시켜 고로에서 제거하는 공정입니다. 고로에는 두 종류의 슬래그가 형성됩니다.
일반 산성광석을 제련할 때 플럭스는 석회석 형태로 용광로에 장입되는데, 플럭스 중의 조(Cao)는 광석 중의 산성산화물과 밀착될 수 없다. 따라서 초기에 형성된 슬래그는 주로 SiO2, Al2O3 및 환원된 FeO의 일부로 형성된 fe2sio4입니다. 슬래그에 FeO가 존재함으로써 슬래그의 융점이 낮아지고 슬래그의 유동성이 좋아진다. 낙하하는 과정(온도가 상승하는 과정이기도 함)에서 슬래그에 포함된 FeO는 점차 감소하여 손실되고, Cao의 함량은 증가하여 최종적으로 최종 슬래그가 노로 유입된다.
자가 플럭스 광석으로 제련할 경우 광석에 Cao가 더 많이 함유되어 있고 산성 SiO2와 잘 접촉할 수 있기 때문에 제련 초기에 Cao가 즉시 슬래깅 반응에 참여하며, 특히 자가 플럭스 소결로 제련할 경우 Cao는 다음과 같은 슬래그를 형성합니다. 소결 공정 초기에 SiO2, Al2O3 등이 존재하므로 이러한 광석의 1차 슬래그에 포함된 CaO 함량이 더 높습니다. 슬래그 환원 과정에서 슬래그 조성도 거의 변하지 않습니다.
고로 제품
고로 제련의 주요 생성물은 선철과 합금철이고, 부산물은 슬래그, 가스, 고로 분진입니다.
선철
선철은 2% 이상의 탄소를 함유한 철 탄소 합금으로 Si, Mn, s, P 및 기타 불순물도 포함되어 있습니다.
선철은 용도와 구성에 따라 두 가지 범주로 나눌 수 있습니다. 하나는 제강용 선철입니다. 선철의 탄소는 화합물 형태로 존재하며 단면은 백철이라고도 알려진 은백색입니다. 다른 하나는 주조 선철입니다. 기계 부품을 만드는 데 직접 사용됩니다.
합금철
철과 모든 종류의 금속 또는 비금속 합금을 합금철(일부는 합금 선철이라고도 함)이라고 합니다. 합금철에는 규소철, 망간철, 크롬철, 페로몰리브덴, 텅스텐철 등 다양한 종류의 합금철이 있습니다.
슬래그, 가스 및 먼지
슬래그, 가스 및 분진은 고로의 부산물입니다. 이전에는 폐기물로 버려졌으나 현재는 건축자재로 널리 사용되고 있습니다.