Three-dimensional printing (3DP), also known as additive manufacturing, rapid prototyping technology, free-forming technology, etc., is based on the principle of discrete-stacking, using computer-assisted layering and superposition molding techniques. Material is added layer by layer to form a 3D solid. Since the concept of 3D printing technology was first proposed by Charles W. Hull in 1986, 3D printing has penetrated into all walks of life and led innovation, resulting in global manufacturing due to its unique advantages in high precision, personalized manufacturing and complex shape construction. Industry change. Biological 3D printing is a cross-application of 3D printing technology in the field of biomedicine, which has important research significance and application prospects. 3D printing technology can be used to create standard models, as well as tailor-made surgical stents for patients. The patient’s bone defect is scanned by medical imaging techniques such as computed tomography (CT) or nuclear magnetic resonance (MRI) to obtain the desired stent model, which is then printed using a three-dimensional printer. This is difficult to achieve with traditional molding techniques. In recent years, 3D printing technology has been widely used in the medical field, including craniofacial transplantation, crown restoration, prosthetic devices, medical equipment, surgical models, organ printing, drug delivery models, bone tissue engineering stents, etc. [1]. 3D printing technology has attracted wide attention from researchers due to its tailorability, structural and pore controllability, and the ability to composite multiple materials. This trend has also inspired many inventions with breakthrough treatments and devices.
Następnie szczegółowo wyszczególnimy biomateriały obecnie dostępne do drukowania 3D w dziedzinie inżynierii tkanki kostnej, w tym ich mocne i słabe strony oraz standardy drukowania. Jednocześnie, ponieważ różne drukarki mogą drukować różne biomateriały, dajemy również krótki przegląd rodzajów i zasad formowania drukarek 3D. Mamy nadzieję, że ten przegląd zachęci więcej zespołów badawczych do wynalezienia nowych biomateriałów, a ostatecznie sprawi, że technologia drukowania 3D będzie bardziej rozwinięta w dziedzinie inżynierii tkanki kostnej.
1. Wprowadzenie do klasyfikacji technologii druku 3D
To, czy można drukować biomateriały, ma wiele wspólnego z używanymi drukarkami 3D. Różne drukarki mają różne wymagania materiałowe. W dziedzinie biomedycyny główne używane drukarki są podzielone na cztery typy: fotoutwardzalna technologia druku stereofonicznego, technologia drukowania z nakładaniem stopionym, technologia selektywnego spiekania laserowego i technologia bezpośredniego wytłaczania zawiesiny.
Techniki osadzania stopionego i bezpośredniego wytłaczania zawiesiny są dwoma powszechnie stosowanymi metodami przygotowania rusztowań do inżynierii tkanki kostnej. Niektóre bezpośrednio drukowane pasty to roztwory polimerów, które są mieszane z wodą lub rozpuszczalnikami o niskiej temperaturze wrzenia (dichlorometan (DCM), dimetylosulfotlenek (DMSO), niektóre są roztworami polimerów, które szybko odparowują po wytłaczaniu lub niektóre hydrożele zachowują swoją pierwotną strukturę po wytłaczaniu. powstają w wyniku trójwymiarowego drukowania, można zachować kształt poprzez zachowanie tiksotropowe, wykrywanie temperatury lub sieciowanie po wytłaczaniu. Do osadzania przez stapianie i drukowania bezpośredniego. Rozdzielczość może wynosić nawet 25 mikronów w płaszczyźnie XY, a warstwa grubość wynosi 200-500 mikronów [2]. Zasadniczo te dwie metody mają problemy z drukowaniem długich nieobsługiwanych lub ostro zakończonych modeli. Filamenty nie mają wystarczającej wytrzymałości, aby się natychmiast utrzymać, więc występuje luźne lub całkowite załamanie w nieobsługiwana część. Aby rozwiązać ten problem, czasami materiał wypełniający jest dodawany podczas procesu drukowania, po zakończeniu drukowania. Rozpuszcza się w rozpuszczalniku lub kalcynowane w wysokiej temperaturze.
Technologia druku 3D w topieniu cząstek jest szeroko stosowana w prototypowaniu przemysłowym, w tym w technologii selektywnego spiekania laserowego i technologii adhezji cząstek, która nie tylko drukuje polimery, ceramikę, metale i ich kompozyty, ale także nadaje im niepowtarzalną lub skomplikowaną strukturę. Selektywne spiekanie laserowe wykorzystuje laser o określonej orientacji, aby doprowadzić cząstki polimeru lub metalu powyżej ich temperatury topnienia, a tym samym stopić cząstki razem. Wiązka laserowa jest nakładana warstwowo zgodnie z modelem komputerowym, a cząstki topi się od góry, a ten etap powtarza się, aby osiągnąć końcowy wynik [3]. Selektywna technologia laserowa jest wolniejsza w budowie, bardziej kosztowna i wymaga użycia dużej ilości materiału, ale jej zdolność do formowania wielu materiałów na jednej obrabiarce wciąż sprawia, że jest hitem w wielu obszarach produkcyjnych. Technologia łączenia cząstek jest również znana jako technologia bezkierunkowego spiekania laserowego, a jej główna zasada jest podobna do technologii selektywnego spiekania laserowego. Jednak w przeciwieństwie do laserowego stapiania cząstek, technika łączenia cząstek wykorzystuje ciekły roztwór spoiwa do wiązania cząstek, a następnie uzyskania trójwymiarowego ciała stałego przez kalcynację w wysokiej temperaturze. W inżynierii tkanek twardych, takich jak ortopedia lub chirurgia jamy ustnej, zastosowano techniki selektywnego spiekania laserowego i techniki adhezji cząstek.
Stereolitografia jest procesem formowania światła ultrafioletowego lub światła laserowego przez zdolny do fotopolimeryzacji ciekły polimer w celu utworzenia pojedynczej, sztywnej folii polimerowej. Po polimeryzacji podłoże jest obniżane do roztworu, dzięki czemu nowa żywica może przepływać nad drukowaną powierzchnią i polimeryzować powyżej. Spośród wszystkich technologii drukowania litografia stereo ma najwyższą rozdzielczość, tradycyjna rozdzielczość litografii stereo osiąga 25 mikronów, podczas gdy litografia stereo w mikroskali i precyzyjna litografia stereo mają rozdzielczość pojedynczego mikrona [4]]. Jednak ze względu na stereolitografię można go sieciować tylko w świetle ultrafioletowym, rozszerzone właściwości po formowaniu, brak odpowiednich właściwości mechanicznych, żywica jest łatwo blokowana na końcu, a co najważniejsze, nie ma odpowiednich faz biologicznych, które można zastosować do stereolitografii . Pojemnościowe i biodegradowalne materiały sprawiają, że nie ma miejsca na rozwój w dziedzinie medycyny. Jednak w ostatnich latach odkrycie niektórych naturalnych lub syntetycznych sieciowalnych biomateriałów dało ogromne możliwości zastosowania stereolitografii w dziedzinie inżynierii tkankowej [5].
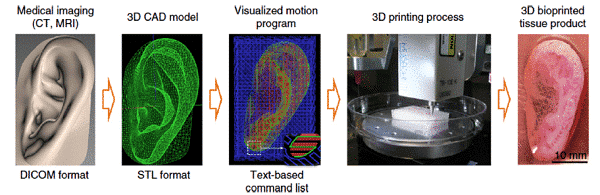
Rycina 1 Jak wydrukować ucho [6]
2. Klasyfikacja materiałów biomedycznych w druku trójwymiarowym
W ciągu ostatnich dziesięciu lat technologia drukowania 3D szybko się rozwinęła, co pozwoliło na jej zastosowanie w wielu nowych dziedzinach i przyciągnęło uwagę sprzętu medycznego i inżynierii tkankowej. Ponieważ drukowanie 3D może w krótkim czasie i przy niskich kosztach dostosować określone produkty medyczne do potrzeb pacjentów, sprawia to, że technologia druku 3D ma duże perspektywy rozwoju w przyszłej erze osobistej medycyny. Obecnie istnieje wiele materiałów biologicznych do przygotowania rusztowań do inżynierii tkanki kostnej lub innych produktów medycznych za pomocą druku trójwymiarowego. W tej sesji przedstawimy przegląd właściwości materiałów wymaganych dla różnych technologii drukowania oraz podkreślymy zastosowane biomateriały oraz ich zalety i wady.
2.1 Ceramiczna zawiesina podstawy
Aktywna ceramika biomedyczna jest idealna do bionicznych materiałów do naprawy kości, symulując fazę mineralną, strukturę i właściwości mechaniczne naturalnej kości. Obecnie trudno jest bezpośrednio drukować materiały ceramiczne za pomocą drukarek 3D, ponieważ ciekłe materiały ceramiczne są małe, a ich temperatura topnienia wykracza daleko poza zakres, który może wytrzymać druk termotopliwy. Ponadto materiały ceramiczne nie nadają się do fotoutwardzania technologii druku trójwymiarowego ze względu na brak właściwości światłoczułych. Trudno jest również wydrukować porowatą strukturę o wysokiej gęstości przy użyciu systemu selektywnego spiekania laserowego. Technologia bezpośredniego wytłaczania 3D jest obecnie najbardziej obiecującą metodą drukowania materiałów ceramicznych. Proszek ceramiczny musi mieć odpowiednią wielkość cząstek (zwykle 10-150 mikronów) i odpowiedni roztwór wiążący, aby ułatwić drukowanie. Formowanie [7].
Proszek hydroksyapatytu jest szeroko stosowany w druku trójwymiarowym, co wiąże się z dużą ilością fosforanu wapnia w jego fazie mineralnej. Roztwór poliakrylowy napylano na warstwę proszku HA warstwa po warstwie, a następnie spiekano w celu zakończenia procesu utwardzania, tak że otrzymaliśmy sprzęganie hydroksyapatytu. Poprzez spiekanie jego wytrzymałość na ściskanie (0,5-12 MPa) może spełniać minimalne wymagania ludzkiej kości gąbczastej. Przeszczepiono go do modelu mysiego, a po 8 tygodniach na brzegu stentu rozpoczęło się tworzenie nowej kości, aw środku wyrosły osteoidy i naczynia krwionośne. Jednak pomimo doskonałego działania sztucznego rusztowania kostnego nadal daleko mu do standardu klinicznego zastosowania [8]. Bioglass to agregat krzemianów, w którym cząsteczki wewnętrzne są losowo rozmieszczone. Składniki w materiale mogą wymieniać się lub reagować ze składnikami w żywym ciele, tworząc substancję kompatybilną z samym organizmem. Naukowcy przeprowadzili serię badań na bioaktywnym szkle poprzez eksperymenty na komórkach i na zwierzętach i stwierdzili, że bioglass ma doskonałą samodegradację, a jego produkt jonowy może zwiększać proliferację i różnicowanie osteoblastów oraz aktywować ekspresję genów osteogennych. Aby skutecznie leczyć związane z nowotworami zaburzenia uboczne kości, Lu i wsp. [9] najpierw przygotowali mezoporowatą bio-szybę modyfikowaną nanocząstkami i zmieszali ją z chitozanem, aby przygotować porowate rusztowanie kompozytowe. Rusztowanie kompozytowe ma dobre funkcje regeneracji kości i terapii fototermicznej oraz ma wielką wartość użytkową w leczeniu wad kości związanych z nowotworem.
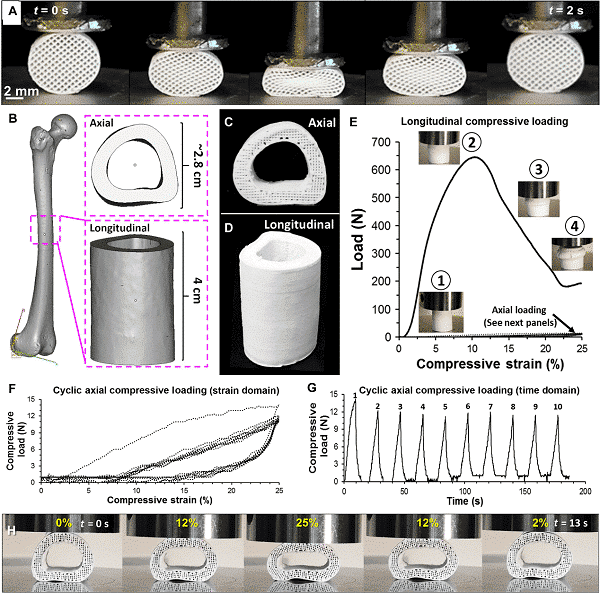
Rycina 2 Sztuczna kość superelastyczna [10]
2.1 Biomedyczne materiały polimerowe
Medyczne materiały do drukowania polimerowego mają doskonałe właściwości przetwarzania, mogą być stosowane w różnych trybach drukowania oraz mają dobrą biokompatybilność i zdolność do rozkładu, co czyni je główną siłą w biomateriałach do drukowania 3D. Różne techniki drukowania wymagają ustawienia różnych parametrów drukowania materiału. Na przykład druk stopionego osadzania wykorzystuje termoplastyczny materiał polimerowy, który można wydrukować, po prostu wciągając surowiec do kształtu filamentu, ale jego średnica wynosi zwykle około 1,75 mm i ma on właściwości konwersji szybkiego roztworu stałego, aby zapewnić, że jest ściśnięty. Szybko topi się przed wyjściem i może być szybko schłodzony po wytłaczaniu. Technologia fotograficznego druku trójwymiarowego wymaga, aby zawiesina była w stanie ciekłym i miała właściwości światłoczułe.
Obecnie najczęściej stosowanymi trójwymiarowymi materiałami polimerowymi do drukowania są degradowalne alifatyczne materiały poliestrowe, takie jak kwas polimlekowy (PLA) i polikaprolakton (PCL). Polikaprolakton jest półkrystalicznym polimerem, który został porzucony aż do powstania inżynierii tkankowej i drukowania 3D, a PCL ponownie znajduje się na scenie historycznej. Polikaprolakton ma doskonałe właściwości reologiczne i lepkosprężyste po podgrzaniu, co czyni go jednym z najważniejszych materiałów do drukarek opartych na osadzaniu stopionym. Polikaprolakton jest stabilny w organizmie przez okres do sześciu miesięcy, po czym następuje stopniowa degradacja, a produkty uboczne są nietoksyczne i nieszkodliwe dla organizmu ludzkiego. Kwas polimlekowy jest liniowym termoplastycznym alifatycznym poliestrem o dobrej biokompatybilności i biodegradowalności. Ponieważ jednak degradację kwasu polimlekowego osiąga się przez hydrolizę wiązań estrowych, uwalnianie kwasu mlekowego powoduje spadek wartości pH w otaczającym środowisku płynów ustrojowych. Te kwaśne produkty uboczne są podatne na zapalenie tkanek i śmierć komórek. Aby rozwiązać ten problem, naukowcy połączyli kwas polimlekowy z bioceramikami, aby przygotować rusztowania kompozytowe w celu poprawy ich bioaktywności i utrudnienia powstawania kwaśnych środowisk. Ion i wsp. [11] zastosowali technikę drukowania 3D do wytworzenia nowej struktury kompozytowej apatyt-wollastonit / kwas polimlekowy (AW / PLA), która odpowiada właściwościom kości korowej i gąbczastej. Wyniki eksperymentów z komórkami in vitro wykazały, że kompozytowe rusztowanie AW / PLA może skutecznie promować proliferację i różnicowanie osteogenne mezenchymalnych komórek macierzystych pochodzących ze szpiku kostnego. W modelu ubytku czaszki szczura kompozytowe rusztowanie wykazało dobrą osseointegrację i zdolność do promowania tworzenia nowej kości.
Oprócz PLA i PCL, polipropylen (PPF) jest jednym z najlepiej przebadanych biodegradowalnych i zdolnych do fotoutwardzania materiałów polimerowych do fotoutwardzania. Zazwyczaj drukowaną pastę miesza się z rozpuszczalnikiem DEF fumaranu dietylu, a także dodaje się fotoinicjator. Lepkość roztworu i stosunek PPF do DEF mają duży wpływ na proces drukowania i właściwości mechaniczne stentu. Polieteroetherketon (PEEK) można wytwarzać tylko za pomocą technologii selektywnego spiekania laserowego ze względu na jego temperaturę topnienia 350 ° C. Jednak wysoka temperatura topnienia zapewnia również odporność na ciepło PEEK, co czyni go stabilnym podczas sterylizacji parowej w wysokiej temperaturze. Jednak jako materiał biologiczny PPEK nie ma osseointegracji sprzyjającej inżynierii tkankowej i nie można go dobrze łączyć z naturalną kością, dlatego łatwo wywołać pewne reakcje odrzucenia, a cena jest droga [12].
2.3 zawiesina hydrożelowa
Hydrożel jest polimerem utworzonym przez chemiczne sieciowanie lub fizyczne sieciowanie polimeru rozpuszczalnego w wodzie, ma trójwymiarową strukturę sieciowanej sieci, a także zawiera dużą ilość samej wody. Hydrożel ma właściwości regulowanej wytrzymałości, podatności na rozkład, modyfikacji funkcjonalnej itp. I może być stosowany jako miękki materiał naśladujący mikrośrodowisko macierzy pozakomórkowej, co sprawia, że hydrożel ma szerokie możliwości zastosowania w medycynie. Można go wykorzystać do przygotowania dwu- lub trójwymiarowych rusztowań do inżynierii tkankowej i kontrolowanego uwalniania leków. Powszechnie stosowane trójwymiarowo drukowane pasty hydrożelowe dzielą się głównie na trzy kategorie: jedną wytwarza się z naturalnych polimerów, takich jak alginian, agar, żelatyna, celuloza, kolagen, fibroina jedwabiu, kwas hialuronowy itp. Jeden rodzaj jest przygotowywany z syntetycznych polimerów, takich jak jako poliakryloamid, poliuretan, glikol polietylenowy itp .; drugi to zawiesina na bazie hydrożelu złożona z polimeru syntetycznego i polimeru naturalnego.
Spośród rozpuszczalnych w wodzie syntetycznych polimerów medyczny alkohol poliwinylowy (PVA) jest szeroko stosowany w dziedzinie inżynierii tkankowej. PVA ma dobrą biokompatybilność, jest nietoksyczny i łatwo ulega rozkładowi, może być rozpuszczony w wodzie o temperaturze 95 ° C, tworzy żel i ma wysoką lepkość. Zhang i wsp. [13] przygotowali rusztowania kompozytowe MBG / PVA z połączonymi porami. Dodatek PVA znacznie poprawił wytrzymałość materiałów. Eksperymenty na zwierzętach z wykorzystaniem modelu ubytku kości czaszki szczura wykazały również, że rusztowanie MBG / PVA ma doskonałą aktywność osteoindukcyjną i sprzyja tworzeniu nowej kości i angiogenezie przy ubytku kości.
Obecnie przeprowadzono wiele eksperymentów, w których komórki są hodowane wspólnie z drukowanymi w 3D bios rusztowaniami. Wyniki pokazują również, że komórki mogą przetrwać na różnych trójwymiarowych rusztowaniach i są lepsze niż zwykłe dwuwymiarowe kultury. Ale to tylko dwuwymiarowy efekt komórek i materiałów i nie umieszcza komórek bezpośrednio w systemie drukowania. Bezpośrednie mieszanie komórek z pastą do drukowania jako nowy pomysł również wzbudziło szerokie zainteresowanie badaczy. Naturalne hydrożele mają dobrą kompatybilność cytową. Jego skład jest podobny do składu macierzy pozakomórkowej, a jego zdolność do przylegania do białek i komórek na powierzchni jest słaba i prawie nie wpływa na proces metaboliczny komórek. Może owijać komórki, transportować substancje odżywcze i wydzielać metabolity. Andrea i in. [14] przetestowali bio-tuszowe formulacje kolagenu typu I i kwasu hialuronowego w różnych proporcjach i wyznaczyli optymalną formułę, która umożliwia bioprint, jednocześnie wspierając aktywność biologiczną i wspierając interakcje natywnej matrycy komórkowej. . Zastosowali ten preparat do budowy trójwymiarowej tkanki wątroby zawierającej ludzkie pierwotne hepatocyty i komórki gwiaździste wątroby i przetestowali działanie acetaminofenu, wspólnego toksycznego dla wątroby. Wyniki pokazują, że połączenie kolagenu metakrylanu metylu i kwasu hialuronowego tiolu daje prosty, drukowalny bio-atrament, który reguluje wzrost komórek mezenchymalnych i leczy leki. Miej właściwą reakcję.
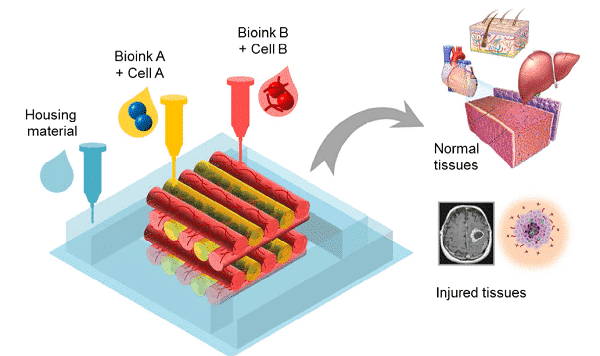
Rycina 3 Bioprint
3. Wnioski i perspektywy
Three-dimensional printing technology has great application prospects, but there are still many problems to be solved as the main members of the biomedical field. One of the problems lies in the limitations of the 3D printer’s own capabilities. Although its printing speed and printing accuracy have been greatly improved, in many cases it still cannot achieve the best level. Another major problem is the limitations of alternative biomaterials. Although many materials that can be printed have their own advantages, the materials used for transplantation must meet the requirements of physiological conditions and have a good response to the human body. In general, ideal orthopedic materials require the following characteristics: (1) printability, (2) biocompatibility, (3) excellent mechanical properties, (4) good degradability, and (5) by-products. Non-toxic and degradable, (6) good tissue biomimetic properties. Different types of printers have different material requirements, and these characteristics are sometimes difficult to fully satisfy. For example, in bone tissue engineering, on the one hand, a high-strength scaffold material is required to meet the growth and load of osteoblasts, but this also causes a problem of difficulty in scaffold degradation. Some soft materials with low strength are easy to print and are easily degraded, but they cannot be applied to load-bearing parts. In general, three-dimensionally printed pastes are used in the field of bone and cartilage repair due to their own hardness and natural bone proximity. Fundamentally, the choice of biomaterials is to balance their performance to achieve the desired material.
Bio-zawiesina polimerowa była szeroko badana, szczególnie w przypadku niedrogich elastomerów, takich jak PLA i PCL. Materiały te mają doskonałą biokompatybilność i właściwości mechaniczne i są szeroko stosowane jako materiały podłoża. Oprócz tego w przyszłych badaniach należy zwrócić uwagę na podatność na rozkład, kruchość i cytokompatybilność materiałów polimerowych. Materiały ceramiczne, takie jak HA i β-TCP, tradycyjnie były uważane za idealne materiały na rusztowania do inżynierii tkanek twardych i są obecnie coraz częściej stosowane w badaniach kompozytów ceramicznych i polimerowych. Dodanie materiałów ceramicznych można poprawić. Wytrzymałość stentu i właściwości biologiczne kompozytu. Rozwój bio-gnojowicy hydrożelowej i systemu drukowania zbliżył nas do drukowania wielofunkcyjnych systemów modelowych montowanych na komórkach i mamy nadzieję, że pewnego dnia zostanie wydrukowany narząd. Proces ten rozpoczął się od badania zawiesiny supramolekularnego hydrożelu. Wreszcie, jeśli technologia druku 3D ma być zastosowana w medycynie, to jak przeprowadzić masową produkcję, jak kontrolować jakość i jak pokonać przeszkody w zarządzaniu, to wszystkie problemy, które należy rozwiązać. Mimo że droga jest długa i długa, druk 3D ostatecznie zabłyśnie w dziedzinie inżynierii tkankowej i medycyny!
Odniesienie
[1] Murphy SV, Atala A. Bioprint 3D tkanek i narządów [J]. Nature Biotechnology, 2014, 32 (8): 773–785.
[2] Guvendiren M, Molde J, Soares RMD, i in. Projektowanie biomateriałów do drukowania 3D [J]. ACS Biomaterials Science & Engineering, 2016.
[3] Vermeulen M., Claessens T., Van Der Smissen, Van Holsbeke, De Backer, Van Ransbeeck, Verdonck. Wytwarzanie specyficznych dla pacjenta optycznie dostępnych modeli dróg oddechowych poprzez modelowanie z fuzji. Rapid Prototyping Journal 2013, 19 (5), 312-318.
[4] Bertrand P, Bayle F, Combe C, Goeuriot P, Smurov I. Produkcja elementów ceramicznych metodą selektywnego spiekania laserowego. Appl. Surfować. Sci. 2007, 254 (4), 989–992.
[5] Derby B. Drukowanie i prototypowanie tkanek i rusztowań [J]. Science, 2012, 338 (6109): 921–6.
[6] Kang, H.-W .; Lee, SJ; Ko, IK; Kengla, C .; Yoo, JJ; Atala, A. System bioprintingu 3D do produkcji konstrukcji tkankowych w skali ludzkiej o integralności strukturalnej. Nat. Biotechnol. 2016, 34 (3), 312–319.
[7] Xiaoyu Du, Shengyang Fu, Yufang Zhu. Drukowanie 3D rusztów na bazie ceramiki do inżynierii tkanki kostnej: przegląd. Journal of material chemistry B, 2018,6: 4397-4412.
[8] Fierz FC, Beckmann F, Huser M itp. Morfologia anizotropowych rusztowań hydroksyapatytowych z nadrukiem 3D. Biomaterials, 2008, 29 (28), 3799–3806.
[9] Jiawei Lu, Fan Yang, Qinfei Ke, Xuetao Xie, Yaping Guo. Modyfikowane porowate rusztowania z nanocząstkami magnetycznymi do regeneracji kości i terapii fototermicznej przeciw nowotworom. Nanomedycyna, 2018, 14 (3) : 811-822
[10] A.E. Jakus, A.L. Rutz, S.W. Jordan, A. Kannan, S.M. Mitchell, C. Yun, K.D. Koube, S.C. Yoo, H.E. Whiteley, C.P. Richter, R.D. Galiano, W.K. Hsu, S.R. Stock, E.L. Hsu, R.N. Shah, Hyperelastic “bone”: A highly versatile, growth factor-free, osteoregenerative, scalable, and surgically friendly biomaterial, Sci Transl Med, 2016, 8:358.
[11] Ion Tcacencu, Natacha Rodrigues, Naif Alharbi, Matthew Benning itp. Osseointegracja porowatych struktur kompozytowych apatyt-wollastonit i poli (kwasu mlekowego) utworzonych przy użyciu technik drukowania 3D. Mater Sci Eng C Mater Biol Appl, 2018, 90: 1-7.
[12] Hoath S.D, Vadillo D.C, Harlen O.G, McIlroy C, Morrison N.F, Hsiao W.K, Tuladhar T.R, Jung S, Martin G.D, Hutchings IM Drukowanie atramentowe słabo elastyczne roztwory polimerów. J. Non-Newtonian Fluid Mech. 2014, 205,1–10.
[13] Zhang, JH; Zhao, SC; Zhu, YF; Huang, YJ; Zhu, M .; Tao, CL; Zhang, CQ Trójwymiarowy druk mezoporowatych rusztowań szklanych zawierających stront do regeneracji kości. Acta Biomater. 2014, 10 (5), 2269-2281.
[14] Andrea Mazzocchi, Mahesh Devarasetty, Richard Huntwork, Shay Soker, Aleksander Skardal. Optymalizacja bioink hybrydowego kolagenu typu I z hialuronianem dla mikrośrodowisk wątrobowych 3D. Biofabrykacja, 2018, 11 (1) : 015003.